PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
Hibridação de orbitais atômicos
Hibridização
Hibridação sp3
Hibridação sp2
Pode ocorrer - Relação do orbital s com dois orbitais p, da mesma forma que ocorre com o boro. Vejamos alguns exemplos: - Estado fundamental A estrutura abaixo revela que o boro é monovalente. 
- Estado ativado

Hibridação sp
Analisando a figura acima, é possível perceber que
os três orbitais híbridos sp2 são idênticos, eles
possuem a mesma forma, estão no mesmo plano, e os
eixos estão a 120º entre eles mesmos.
Outros casos de
hibridização
A hibridização não é dependente da ativação, desta forma é possível formar orbitais híbridos, onde também não é possível a ativação de átomos, como por exemplo, nitrogênio, entre outros. O que diferencia a hibridização do nitrogênio e do carbono, por exemplo, é que no nitrogênio o híbrido formado é sp3 , o orbital 2s completo é apresentado pelo carbono. Não é regular a configuração tetraédrica que se pretendia para os orbitais sp3 do nitrogênio, pelo fato de que os três orbitais ter apenas 1 elétron, forma-se ângulos menores de 109º 18°. Vejamos um exemplo, da molécula de NH3. O ângulo resultante foi construído pelos orbitais do nitrogênio. É importante sabermos que o ângulo do nitrogênio forma 107°. N: 1s2 2s2 1p3. 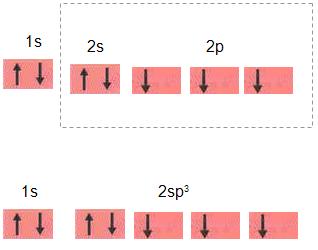 Orbital completo de híbridos sp3 do N.
Pirâmide trigonal da molécula da amônia.
Quando a molécula de amônia se liga a um próton, ocorre a formação do íon de amônia; Tetraédrico, íon de amônio:
É importante lembrar
que as representações de híbridos que
foram produzidas para nitrogênio e
oxigênio, podem ser utilizadas para os
outros elementos dos seus grupos, como
por exemplo, pelos átomos cereais, ou
seja, oxigênio, enxofre, selênio,
telúrio, nitrogênio, fósforo, arsênio,
antimônio.
Estrutura do PCl5
PCl5 (pentacloreto de sódio), ocorreu que o fósforo constituiu 5 ligações covalentes.
Para que ocorram
essas ligações é preciso que 5 elétrons
não estejam emparelhados, para isso é
necessário que um elétron do orbital 3s
passe para o orbital 3d. Vejamos:
Estrutura do SF6
Ocorrem 6 ligações covalentes no SF6 (hexafluoreto de enxofre), constituindo assim 6 ligações covalentes.
Dois dos orbitais 3d
recebem um elétron do orbital 3s e um
elétron do orbital 3p.
Este site foi atualizado em 04/03/19 |